如果你要写肠道,就不能只写肠道。你要写胃肠道居住着大约5亿个神经元组成的肠神经系统产生人体50%的多巴胺和约90%的5-羟色胺影响你的情绪;你要写超过100万亿个微生物组成的肠道菌群产生的神经递质γ-氨基丁酸帮你控制恐惧和焦虑;你要写肠道包含70%的人体免疫细胞帮你免疫各种病原体的侵害;你要写人体的“第二大脑”肠脑轴(Gut-Brain Axis)……
近期很多肠脑轴的研究人员询问绘谱君,通过微生物扩增子测序、宏基因组、代谢组学,筛到了与疾病关联的关键细菌和代谢物,后续如何设计实验进一步确定因果关系?
2023年一篇发表在Nature Protocols“基于LC-MS/MS的靶向代谢组学,通过体外细菌和类器官培养及体内无菌小鼠模型,对哺乳动物肠-脑轴进行研究”的文章给出了研究范式。动物模型在探究大脑和肠道间的双向交流中发挥着关键作用,但目前大部分研究都集中在复杂的微生物群落上,很难确定特定微生物对宿主神经系统的贡献。作者借助靶向代谢组学、细菌培养、体外(类器官)和体内小鼠模型解析共生微生物和宿主复杂代谢物评估的系统化策略;该方法可专门识别微生物信号 (体外和体内)并将它们与宿主内部的变化相关联。

哪些微生物驱动宿主代谢物的改变?
胃肠道中有一个丰富多样的微生物群落,统称为肠道菌群。肠道微生物群包括厚壁菌门、拟杆菌门、放线菌门、变形菌门和疣微菌门等。肠道菌群在婴儿出生后不久就会形成,并随着宿主年龄的增长而波动。在发育早期,婴儿期肠道通常以放线菌门的双歧杆菌为主,微生物和宿主在这个重要窗口期之间的相互作用被推测对中枢神经系统(CNS)的正常发育至关重要。青春期后,肠道微生物群被认为是稳定的,主要是细菌门和厚壁菌门。这些衰老过程中成分的变化代表了饮食、环境和潜在的宿主需求的良性循环。除了维持肠道环境外,人们逐渐认识到其对其他远端器官的影响。过去十年,研究人员已经认识到胃肠道和大脑之间重要的双向联系即“肠-脑”轴。肠道微生物通过多种途径与大脑进行交流:细菌代谢物(如短链脂肪酸(SCFAs)和肽聚糖)、神经递质(如γ-氨基丁酸(GABA)、组胺)、色氨酸代谢、肠内分泌细胞激活、免疫调节及刺激肠神经系统(ENS)和迷走神经。肠道微生物群与焦虑、肥胖、自闭症、精神分裂症、帕金森病和阿尔茨海默氏症的密切联系体现其在中枢神经系统健康中的作用。哪些微生物驱动了宿主特定中枢神经系统的改变?
基于LC-MS/MS代谢组学方法利用体外(培养基和类器官模型)和体内(单个微生物定植的无菌小鼠)系统检测细菌代谢物,定量宿主来源的神经递质和SCFAs。本文选择两种人类肠道中常见的齿双歧杆菌和卵形拟杆菌结合培养基、类器官和已知菌动物解析单个微生物对宿主神经递质的影响,以明确特定的细菌如何改变肠道和中枢神经系统。
方法步骤概述
1. 微生物模型的工作流程
特定细菌如何改变肠道和中枢神经系统?研究不同类型微生物组模型的一般工作流程由三部分组成:
阶段1. 使用培养基生成微生物代谢物来识别微生物来源的神经递质和SCFAs(步骤1-24);
阶段2. 利用小鼠或人类类器官体外研究微生物代谢物对肠上皮的影响,确定产生神经递质的肠内分泌细胞对细菌产物的反应(步骤25-47);
阶段3. 体内研究,使用单个微生物定植的已知菌小鼠进行体内研究,以确定肠道和大脑如何对微生物定植做出反应(步骤48-52)。
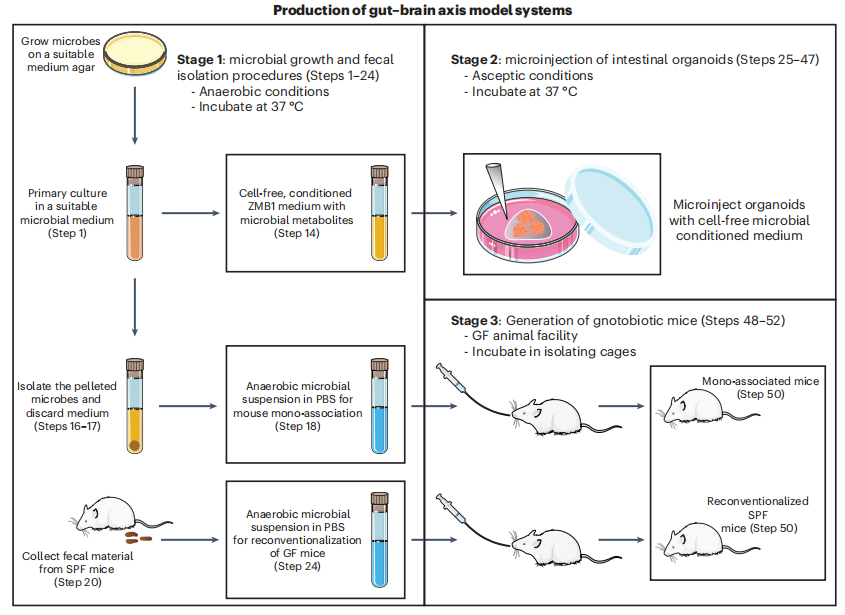
图1. 不同类型微生物组模型的一般工作流程
2. 各样品收集方法和前处理步骤
(步骤53-56)介绍采集粪便样本、安乐死、收集和处理各种组织的过程,包括脑组织(步骤57-69)、肠道内容物(步骤70-79)和粪便(步骤80-86)。
(1)代谢物的无细胞微生物条件培养基(步骤9-14用于微生物培养和条件微生物培养基处理,步骤87B(i-iii)用于色氨酸、酪氨酸途径和谷氨酸循环分析,步骤87A(i-v)用于培养基中SCFA分析);
(2)含代谢物的无细胞微生物条件培养基注射类器官培养基(步骤25-47);
(3)肠道冲洗(步骤53-54、56和70-79);
(4)脑匀浆(步骤53-54、56和57-69);
(5)粪便样本(步骤53-55、80-86和附87A(i-ii)和(vi-viii),用于均质粪便样本提取物中的SCFA分析)。
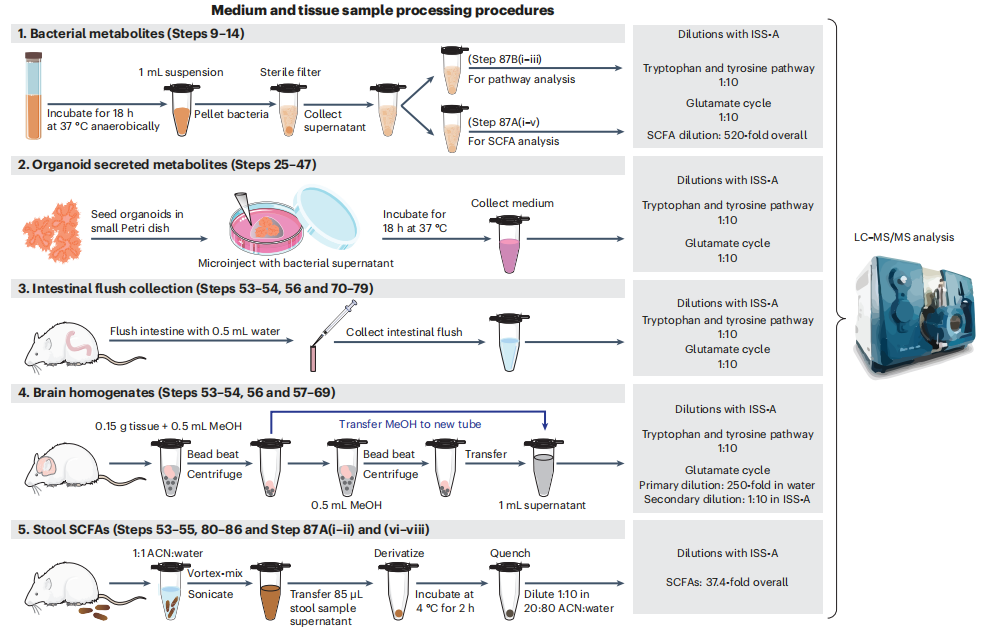
图2. 各样品采集方法和处理步骤
3. LC-MS/MS靶向代谢组学方法优化
因液相色谱分离具有广泛的色谱柱选择和优异的分离技术(如反相(±离子配对),亲水交互色谱(HILIC),和离子交换、手性和正相色谱),使用单一的MS仪器平台可以覆盖多种物理化学性质的微生物和宿主产生的代谢物。基于LC-MS/MS的靶向代谢组学工作流程使用三重四极杆质谱检测,标准品和同位素内标(IS)建立标准曲线,进行高精度和准确的定量。图3a突出显示了神经递质的代谢途径及使用LC-MS/MS方法检测这些途径生成的相应色谱图。图3b确定了SCFA分析物的衍生化前和衍生化后的化学结构及用于衍生化反应的试剂。
色氨酸和酪氨酸途径代谢物的定量方法基于反相离子色谱分离,使用含有七氟丁酸的流动相。谷氨酸循环法基于HILIC,使用含有甲酸铵和甲酸的流动相进行流动相缓冲。最后,SCFA方法利用π-π叠加交互联苯的芳香功能分析柱和芳香环的衍生品产生的衍生化反应分离所有SCFA衍生物。
作者对SCFA、色氨酸、酪氨酸途径和谷氨酸循环靶向代谢组学方法进行一维方法基准评估,即使没有酪氨酸、色氨酸、谷氨酸、谷氨酰胺和乙酸的培养基仍表现出高化学背景,干扰几种代谢物的定量。本研究制备一种可以培养多组生物体的明确培养基且可用于SCFA和神经递质的分析,如ZMB1中SCFA和神经递质的分析。ZMB1是一种培养各种微生物(双歧杆菌,拟杆菌,链球菌,乳酸杆菌,乳球菌,梭状芽胞杆菌等)的培养基,并适用于LC-MS/MS的代谢组学分析。

图3. 部分代谢途径和LC-MS/MS色谱图
实验设计
1. 微生物代谢物的产生
细菌可以从供应商处购买(如美国培养收集(ATCC), DSM德国微生物收集)或从临床环境中获得。每次实验应使用分光光度计检查600nm (OD600nm)处的光密度,并使用40×或60×物镜在显微镜上检查微生物形态,以监测微生物的生长。微生物应定期进行革兰氏染色和选择性培养基培养的污染检测。建议在厌氧室中培养厌氧菌,兼性厌氧菌可以在好氧或低氧条件下生长(如带有厌氧气体生成小袋或蜡烛罐的容器系统中; 兼性厌氧菌表达的特定代谢途径可能受到其培养的大气条件的影响。对于厌氧微生物,必须预先还原化学成分明确的培养基以支持其生长。为了使各组之间的微生物代谢物标准化,建议收集无细胞微生物条件培养基,其包含在相同培养基中产生的代谢物,在相同的孵育条件下,在特定的细菌生长阶段,通过OD600nm随时间监测。
2. 微生物选择,小鼠菌株,定殖验证和体内研究的样品收集
单相关克隆小鼠产生需要的GF动物设施和选择感兴趣的细菌是实验设计的关键部分。肠道微生物几乎都在GF小鼠体内定植。然而,微生物在非天然宿主中的定殖效率可能会有所不同,需要定期检查微生物的定殖状态以确保成功定殖,建议从隔离器内的笼子中收集粪便,提取基因组DNA并通过PCR确认所选微生物的存在。粪便微生物可以在选择性琼脂上生长,并检查集落形成单位(CFU),以确认定植和活力。最后,粪便可直接进行16S核糖体RNA测序确认微生物谱。
实验小鼠品系选择:成功定殖雄性和雌性成年Swiss-Webster和C57B6/J小鼠并对品种进行优化。选择小鼠模型时应考虑某些微生物可能无法在不同遗传背景的小鼠或老年小鼠中定植。本实验选择产仔量大,培育能力强的远交Swiss Webster GF小鼠,近亲繁殖的小鼠遗传变异增加,基因敲除/敲入模型可用于近交系如C57BL/6J。因此,选择哪种小鼠品系最能解决感兴趣的科学问题至关重要。
微生物定殖时间:本研究用牙芽孢杆菌或卵形芽孢杆菌定殖17天的成年无菌小鼠(图4),建议每组至少4只小鼠进行初步研究,以确定定植水平与神经递质和SCFA浓度变化的稳健性。
粪便是否冻干:从动物组收集的粪便颗粒重量大致相同,粪便样本的含水量没有被去除,因此在分析代谢物之前建议通过冻干去除水分。在腹泻情况下,从粪便中去除水分可能很重要。但粪便冻干的弊端是样品基质中挥发性SCFA的潜在损失。因此,仅在粪便重量预计在组间有变化的情况下对粪便进行冻干。
3. 肠道类器官和培养形式的选择
由肠道干细胞产生的组织来源的类器官可以分化为与它们来源的胃肠道部分相关的所有细胞类型。例如,从结肠中收集的活检或组织将包含干细胞、肠内分泌细胞、肠细胞和杯状细胞。从小肠(十二指肠、空肠或回肠)收集的活检或组织将包含干细胞、肠内分泌细胞、肠细胞、杯状细胞、潘氏细胞和簇状细胞。使用类器官系统的优势在于保留了其片段的特异性,并且片段在细胞类型、转运体、粘蛋白分泌、激素分泌和功能方面存在差异。类器官可以来自于各种动物(老鼠、猪、牛、马等)和人类。综上该系统提供了比较多个物种、在小鼠和人类之间进行直接比较的能力,肠道类器官也可以由具有特定疾病表型的个体产生,因此肠道类器官有多种应用优势。
小鼠和人肠道类器官可以在3D或2D中培养,3D形式是最容易培养肠道类器官的,并且类器官向内的管腔可以微注射微生物或微生物代谢物来模拟肠道环境。该显微注射平台已被证明可以在3D类器官模型中创建稳定的厌氧微生物群落。为了避免对显微注射的要求,可以在传代后将微生物添加到类器官培养中。传代会破坏类器官结构,当类器官重组时,微生物被困在管腔内。然而很难控制每个类器官所接收到的微生物负荷相同。微生物或代谢物也可以添加到3D类器官的外侧但可能不会产生生物学上相关的信号级联。类器官可以在基质外培养,类器官固有地逆转其结构,暴露在顶端表面。在这种情况下,微生物或微生物代谢物可以直接添加到培养基中,并与顶膜相互作用,这种“由内而外”的方法非常适合于研究兼性厌氧菌和微生物代谢物。
4. 类器官研究优势
大多数使用小鼠检测肠脑轴的研究都使用具有完整肠道菌群的SPF小鼠。然而,肠道菌群的复杂性使这些研究难以解释。本研究基于LC-MS/MS分析用单一微生物物种定植的已知菌动物模型中的肠道和脑神经递质及SCFA,能够解决特定微生物对肠道和大脑的影响问题。
涉及微生物-宿主互作的研究随着类器官培养的进步正逐步扩大。类器官,又称类肠或类结肠,来源于供体肠道组织,与传统的癌症来源或永生化细胞系相比,具有几个关键优势:(1)保留区段特异性;(2)所有肠细胞类型的表达;(3)产生肠粘液层;(4)干细胞的维持;(5)激素分泌。使用类器官模型可以剖析微生物和宿主上皮之间的信号传导如关注上皮肠内分泌激素。本方案的体外技术可用于原代类器官(从组织部位分离),多能干细胞或胚胎干细胞的类器官及其生成的多种组织类型如胃肠道和大脑类器官,类器官还可以从健康个体或特定患者群体产生,适合解决与微生物-宿主互作相关的研究问题。
靶向代谢组学方法为解析共生微生物与宿主之间复杂的双向相互作用的提供了重要工具,使微生物代谢物,类器官和已知菌小鼠,研究人员可以特异性地识别体内外微生物信号并将它们与宿主内的变化联系起来,可用于开发设计微生物混合物或新一代益生菌。
5. 具体实验流程
Step1. 在ZMB1培养基中培养厌氧菌,收集细菌代谢产物
Step2. 准备供定植的细菌或粪便
Step3. 肠类器官显微注射
Step4. 无菌小鼠准备
Step5. 脑组织分离和代谢物提取
Step6. 肠道内容物收集和代谢物提取
Step7. 粪便样品代谢物提取
Step8. LC-MS/MS分析制备的生物样品
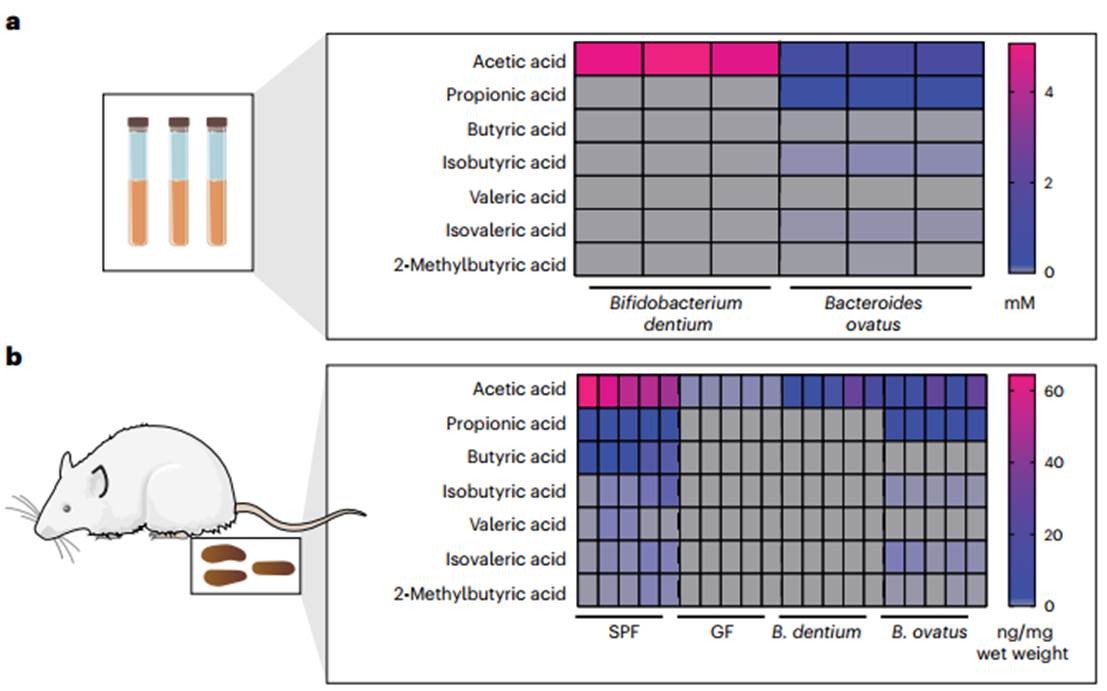
图4. 体外培养基和体内粪便样本中SCFAs的绝对浓度
肠-脑轴研究热点促进了分析微生物和宿主来源定量分析平台的发展,对体外(类器官)和体内小鼠模型系统中代谢物的综合评估策略:阶段1-微生物在确定的培养基中生长;阶段2-肠道类器官显微注射;阶段3-动物模型的生成,包括无菌(无微生物)、无特定病原体(完整肠道微生物群)和无特定病原体再常规化(无菌小鼠与来自无特定病原体小鼠的完整肠道微生物群相关),及牙双歧杆菌和卵形拟杆菌单相关小鼠(无菌小鼠定植单一肠道微生物)。建立了液相色谱-串联质谱的代谢组学方法用于分析这些样品中微生物衍生的短链脂肪酸和神经递质。约4-5周即可完成该方案中细菌培养、类器官培养和体内样本三种实验模型、菌群衍生代谢物定量、数据下机和归一化、统计分析等。
绘谱帮你测
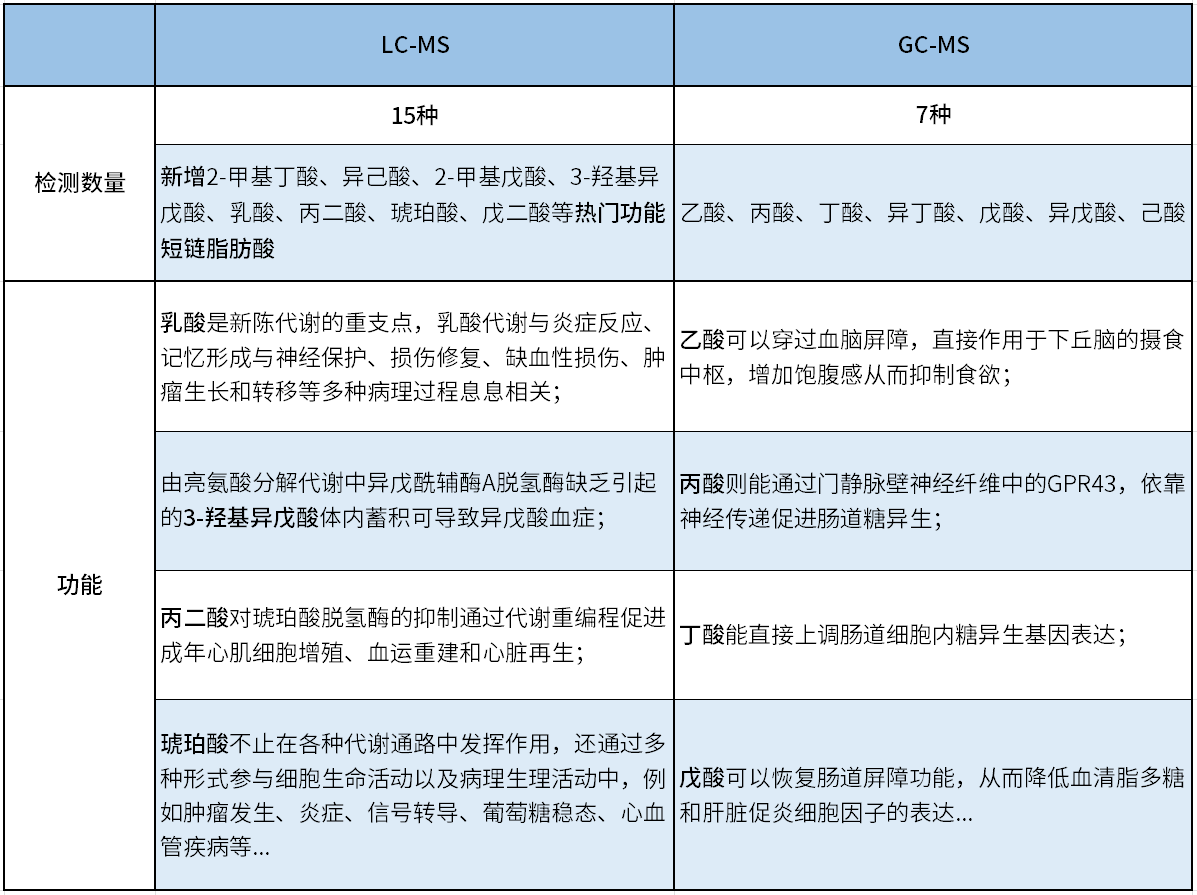
SCFAs是最重要的宿主-微生物代谢相互作用的途径,在不同组织中浓度差异较大,给检测带来一定的困难。麦特绘谱联合代谢组学研究常用的LC-MS和GC-MS两大技术平台,配合使用衍生化、同位素内标等方法定量绝对浓度,精准适配多种样本类型中SCFAs的检测。
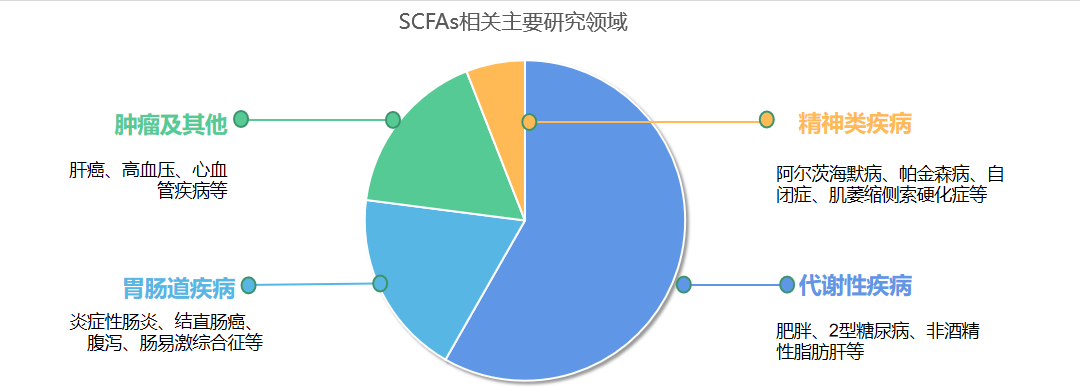
备注:检索各领域文献数量占比
参考文献
Horvath Thomas D,Haidacher Sigmund J,Engevik Melinda A, et al. Interrogation of the mammalian gut-brain axis using LC-MS/MS-based targeted metabolomics with in vitro bacterial and organoid cultures and in vivo gnotobiotic mouse models. Nat Protoc. 2023
请扫描二维码阅读原文

往期回顾
1. Nature子刊 | 短链脂肪酸在微生物-肠-脑通讯中的作用(综述)
4. Nature Metabolism | 胆汁酸新功能–通过肠脑轴影响食欲
5. 肠道微生物组–代谢组关联分析新策略及其在“脑-肠-菌群”轴研究中的初步应用
6. GUT : 丁酸盐通过肠-脑神经回路降低食欲并激活棕色脂肪组织

